
27 jan Alchajmerova demencija – od prepoznavanja do lečenja
Alchajmerova demencija (AD) je oboljenje za koje znamo odavno i koje je proučavano gotovo sto godina unazad. Poslednje decenije donele su značajne pomake u sagledavanju ćelijskih i molekularnih mehanizama uključenih u patogenezu ove bolesti. Nasuprot tome, AD i dalje lečimo lekovima koji ostvaruju simptomatski efekat. Upravo ova kompleksna, multifaktorijalna patogeneza bolesti predstavlja kamen spoticanja u pronalaženju efektivnog leka koji bi posedovao potencijal da zaustavi bolest i promeni njen tok.
Pre svega, treba istaći činjenicu da se očekivanja od formalne terapije obolelih od AD i njihovih negovatelja razlikuju od očekivanja lekara koji ih leče. Za bolesnika i njegove negovatelje važno je ubažiti posledice kognitivnog propadanja koje se odražavaju na bolesnikov svakodnevni život, dok su lekari često više usresređeni na simptome same po sebi (1). Cilj lečenja je da se obezbedi optimalni kvalitet života bolesnika tokom čitavog toka bolesti, sa težnjom da se poveća njegova funcionalna sposobnosti i promoviše nezavisnost obolelog dokle god je to moguće. Ovakav pristup olakšava kliničarima, neurolozima i psihijatrima, da se fokusiraju na područje svoje stručnosti, a to je pre svega farmakološko lečenje AD.
Modulacija poremećene neurotransmiterske aktivnosti osnov je delovanja dve grupe aktuelno odobrenih i raspoloživih lekova u terapiji AD koji obezbeđuju somptomatski tretman.
Poznato je da je holinergički neurotransmiterski sistem jedan od glavnih I odgovornih aktera u patogenezi kognitivnog poremećaja u AD (2,3).
Poremećaj funkcije holinergičkog sistema nastaje usled smanjenja aktivnosti holin-acetil transferaze, smanjenog preuzimanja holina, smanjene sinteze I promena na samim acetilholinskim receptorima (4). Holinesterazni inhibitori (ChEI) delimično kompenzuju deficit acetilholina koji je prisutan u AD, dovodeći do inhibicije degradirajućeg enzima acetilholinesteraze čime omogućavajući porast i bolju raspoloživost ovog neurotransmitera u mozgu koji je ključan za neurone uključene u procese učenja I pamćenja.
U ovom trenutku na raspolaganju su nam tri leka iz ove grupe, preporučena za primenu u blagoj i umerenog AD. Donepezil: specifični selektivni reverzibilni inhibitor acetilholineseraze, enzima koji učestvuje u razgradnji acetilholina; Rivastigmin svoj efekat ostvaruje inhibicijom enzima acetilholinesteraze i butirilholinesteraze i pored tableta prisutan je i u obliku transdermalnog flastera. Glantamin pored svojstva da inhibira acetilholinesterazu, deluje i kao alosterički modulator nikotinskog acetilholinskog receptora.
Farmakološke studije pokazale su da sva tri leka, bez značajne međusobne razlike u efikasnoti ostvaruju povoljan efekat na kognitivne sposobnosti i funkcionalnost bolesnika u svakodnevnom životu, kao i da redukuju intenzitet bihevioralnih simptoma čime doprinose poboljšanju kvaliteta života pacijenata i negovatelja (5).
Lečenje CHEI treba započeti odmah nakon postavljanja dijagnoze, a prvenstvo pri izboru treba dati leku koji je pacijentu jednostavniji za primenu i koji se bolje podnosi.
Zbog neželjenih efekata koji su najčešće gastrointestinalni, često prolazni, lekovi ove grupe uvode se postepeno prema predviđenoj titracionoj šemi do efektivne doze tj. maksimalne doze koja se dobro podnosi, imajući u vidu činjenicu da je efikasnost leka dozno zavisna. Izostanak efekta ili nepodnošenje inicijalnog ChEI nije prediktivna za sličan efekat sa drugim ChEI. U slučaju nepodnošenja, drugi ChEI se uvodi tek nakon potpunog smirivanja neželjenih efekata prvog, sa uobičajenom startnom dozom po preporučenoj titracionoj šemi.
U slučaju izostanka efekta, pod kojim se podrazumeva neadekvatan odgovor na terapiju unutar prve godine lečenja ( pogoršanje kognitivnog statusa, pad MMSE za najmanje 2 poena u prethodnih 6-12 meseci kao i dokumentovano pogoršanje funkcionalnosti, globalnog utiska, neuropsihijatrisjkih simptoma u prethodnih 6-12 meseci), zamena se vrši odmah, sa uobičajenom startnom dozom, uz kraći period titracije do pune doze (6).
Sa druge strane glutamat je primarni ekscitatorni neurotransmiter u regiji hipokampusa i moždanog neokorteksa koji igraju ključnu ulogu u procesu kognicije, učenja I pamćenja. Višak glutamata koji postoji u AD usled povećanog presinaptičkog oslobađanja i smanjenog preuzimanja dovodi do toničke aktivacija NMDA receptora na postsinaptičkim membranama, što je u osnovi mehanizma ekscitotočsičnosti, za koji se smatra da nastaje u kasnijem toku bolesti (7). Memantin hidrohlorid, preporučen za primenu u umerenoj I teškoj AD, je parcijalni antagonista NMDA receptora i zapravo blokira negativne konsekvence povišene glutamatergičke aktivnosti. Pored pokazanog značajnog efekta na poboljšanje kognitivnih , očuvanje globalnog stanja i aktivnosti dnevnog života, moguće je da ostvaruje i neuroprotektivni efekat (8,9).
Na osnovu velikog broja studija koje su se bavile analizom efikasnosti kombinovane terapije ChEI i Mamantina ustanovljeno je da primena kombinovane terapije opravdana kod pacijenta sa umerenom i teškom AD, kao i da je superiornija je u pogledu ublažavanja bihejvioralnih simptoma u odnosu na monoterapiju ChEI. Mehanizam kojim bi kombinovana terapija uticala na poboljšanje bihevioralnih simptoma, kognicije i globalnog statusa pacijenta nije u potpunosti jasan. Najočiglednije objašnjenje je u potenciranju individualnog simptomatskog povoljnog efekta svakog pojedinačnog leka. (10) U pogledu efekta kombinovane terapije kao terapije koja bi uticala na promenu toka bolesti nema dovoljno dokaza (11,12).
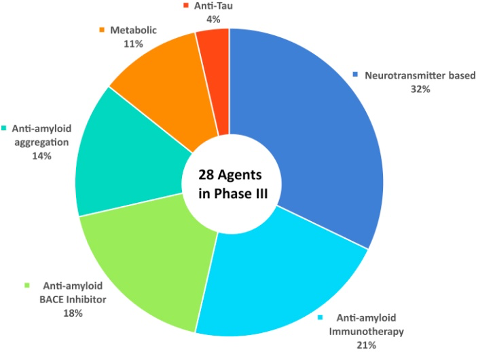
Kada je reč o novim terapijskim opcijama najveći fokus usmeren je i dalje u pravcu anti amiloidnih i anti Tau strategija, koje bi mogle predstavljati ključnu terapiju u bliskoj budućnosti. Aktuelno je u toku ispitivanje većeg broj agenasa (13). (Sl. 1 i 2)
Iako mnoge kliničke studije do sada nisu dale očekivane rezultate, ostaje da se nadamo da će nova saznanja i učenje na dosdašnjim greškama uroditi plodom.
Slika 1. Usvojeno od Cummings J et al. Alzheimers Dement, 2017.
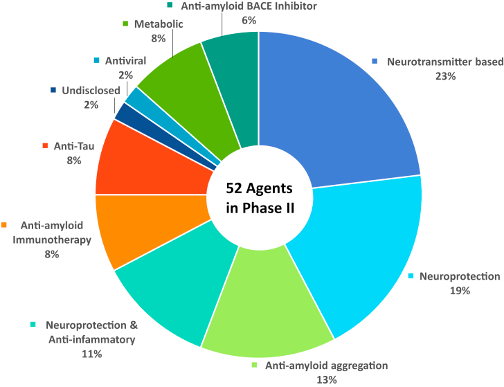
Slika 2.
Iz perspektive onoga čime raspolažemo u ovom trenutku važno je da se istakne da oboleli od demencije i njihove porodice često imaju nerelana očekivanja u pogledu efektivnosti i ograničenja dostupnih lekova, a time i u pogledu prognoze bolesti (14). Važno je predočiti da ovi lekovi ne mogu da zaustave demenciju ali da uspešnost lečenja može biti u manjim promenama kao i u stabilizaciji stanja bolesnika. Lečenje AD bi trebalo da bude fokusirano i planirano u odnosu na potrebe, stanje i raspoložive resurse svakog bolesnika ponaosob. Terapijsko delovanje, kako farmakološko tako i nefarmakološko, bi trebalo da bude usmereno u pravcu poboljšanja oštećenih funkcija, ukoliko za to postoji potencijal i na prilagođavanje na ono što je nažalost nepovratno izgubljeno.
Literatura:
- Rockwood K. The measuring, meaning and importance of activities of daily living (ADLs) as an outcome. Int Psychogeriatr. 2007 Jun;19(3):467-82
- Berger-Sweeney J. The cholinergic basal forebrain system during development and its influence on cognitive processes: important questions and potential answers. Neurosci Biobehav Rev. 2003 Sep;27(4):401-11.
- Schliebs The significance of the cholinergic system in the brain during aging and in Alzheimer’s disease. J Neural Transm (Vienna). 2006 Nov; 113(11):1625-44.
- Xu Y et al. Neurotransmitter receptors and cognitive dysfunction in Alzheimer’s disease and Parkinson’s disease. Prog Neurobiol. 2012 Apr;97(1):1-13
- Lanctôt KL. Therapy for Alzheimer’s disease: how effective are current treatments? Ther Adv Neurol Disord. 2009 May;2(3):163-80.
- Overshott R . Treatment of dementia. J Neurol Neurosurg Psychiatry. 2005 Dec;76 Suppl 5:v53-9
- Hellweg R. Efficacy of memantine in delaying clinical worsening in Alzheimer’s disease (AD): responder analyses of nine clinical trials with patients with moderate to severe AD. Int J Geriatr Psychiatry 2012; 27(6):651–6.
- Emre M et al. Pooled analyses on cognitive effects of memantine in patients with moderate to severe Alzheimer’s disease. J Alzheimers Dis. 2008 Jun; 14(2):193-9.
- Wilkinson D et al. Analysis of the effect of memantine in reducing the worsening of clinical symptoms in patients with moderate to severe Alzheimer’s disease. Dement Geriatr Cogn Disord. 2007;24(2):138-45
- Schmidt R et al. EFNS-ENS/EAN Guideline on concomitant use of cholinesterase inhibitors and memantine in moderate to severe Alzheimer’s disease. Eur J Neurol. 2015 Jun;22(6):889-98.
- Atri A et al. Cumulative, additive benefits of memantine-donepezil combination over component monotherapies in moderate to severe Alzheimer’s dementia: a pooled area under the curve analysis. Alzheimer’s Research & Therapy. Alzheimers Res Ther. 2015 May 18;7(1):28.
- Gareri P et al. Retrospective study on the benefits of combined Memantine and cholinEsterase inhibitor treatMent in AGEd patients affected with Alzheimer’s disease: The MEMAGE Study. J Alzheimers Dis. 2014;41(2):633-40.
- Cummings J et al. Alzheimer’s disease drug development pipeline: 2017. Alzheimers Dement (N Y). 2017 May 24;3(3):367-384.
- Manthorpe J. From forgetfulness to dementia: clinical and commissioning implications of diagnostic experiences. Br J Gen Pract. 2013 Jan;63(606):e69-75.
doc. dr Smiljana Kostić,
Klinika za neurologiju, VMA, Beograd
Medicinski fakultet Univerzitet odbrane
